SPEXOTRAS 0,05 mg-mL, poudre pour solution buvable, boîte de 1 flacon ( seringue pour administration orale) de 90 ml
Dernière révision : 02/05/2025
Taux de TVA : 2.1%
Prix de vente : 505,47 €
Taux remboursement SS : 100%
Base remboursement SS : 505,47 €
Laboratoire exploitant : NOVARTIS PHARMA
Gliome de bas grade
Spexotras est indiqué en association au dabrafenib pour le traitement des patients pédiatriques âgés de 1 an et plus atteints d'un gliome de bas grade (GBG) porteur d'une mutation BRAF V600E qui nécessitent un traitement par voie systémique.
Gliome de haut grade
Spexotras est indiqué en association au dabrafenib pour le traitement des patients pédiatrique âgés de 1 an et plus atteints d'un gliome de haut grade (GHG) porteur d'une mutation BRAF V600E qui ont reçu au moins un traitement antérieur par radiothérapie et/ou chimiothérapie.
Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique Liste des excipients.
Spexotras est destiné à être utilisé en association au dabrafenib en comprimés dispersibles car les données d'efficacité du dabrafenib en monothérapie et du trametinib en monothérapie dans les gliomes présentant une mutation BRAF V600 sont limitées. Le RCP du dabrafenib en comprimés dispersibles doit être consulté avant l'initiation du traitement. Pour plus d'informations sur les mises en garde et les précautions d'emploi associées au traitement par dabrafenib, veuillez vous référer au RCP de dabrafenib en comprimés dispersibles.
Détection de BRAF V600E
L'efficacité et la sécurité du trametinib en association au dabrafenib n'ont pas été établies chez les patients atteints d'un gliome non porteur d'une mutation BRAF V600E.
Nouvelles tumeurs malignes
De nouvelles tumeurs malignes, cutanées ou non cutanées, peuvent survenir lorsque le trametinib est utilisé en association au dabrafenib.
Tumeurs
cutanées
Des tumeurs
cutanées malignes telles que des carcinomes épidermoïdes cutanés (CEC) incluant
des cas de kératoacanthome et de nouveaux mélanomes
primitifs ont été observés chez les patients adultes traités par trametinib en association au dabrafenib
(voir la rubrique Effets indésirables). Il est recommandé d'examiner la
peau du patient avant l'initiation du traitement par trametinib
puis mensuellement pendant le traitement et jusqu'à 6 mois après le traitement.
Le contrôle de la peau doit continuer pendant 6 mois après la fin du traitement
par trametinib ou jusqu'à l'initiation d'un autre
traitement antinéoplasique.
Les lésions de la peau suspectes doivent être prises en charge par une exérèse chirurgicale et ne nécessitent pas de modification du traitement. Les patients doivent être informés d'avertir immédiatement leur médecin en cas d'apparition d'une nouvelle lésion de la peau.
Tumeurs
malignes non cutanées
Sur la base de
son mécanisme d'action, le dabrafenib pourrait majorer
le risque de tumeurs malignes non cutanées en présence de mutations RAS. Veuillez vous référer au RCP du dabrafenib
en comprimés dispersibles (rubrique Mises en garde
spéciales et précautions d'emploi). Lorsqu'il est pris en association au dabrafenib, aucune adaptation posologique du trametinib n'est nécessaire pour des cancers avec une
mutation RAS.
Hémorragie
Des évènements hémorragiques ont été rapportés chez des patients adultes et pédiatriques traités par trametinib en association au dabrafenib (voir la rubrique Effets indésirables). Des événements hémorragiques majeurs et des hémorragies d'issue fatale, sont survenus chez les patients adultes traités par trametinib en association au dabrafenib. Le risque potentiel de ces évènements chez les patients présentant un taux de plaquettes bas (< 75 000/mm3) n'a pas été établi étant donné que ces patients avaient été exclus des études cliniques. Le risque hémorragique peut être majoré par l'utilisation concomitante de médicaments antiplaquettaires ou anticoagulants. En cas d'hémorragie, les patients doivent être traités en fonction de la situation clinique.
Diminution de la fraction d'éjection du ventricule gauche (FEVG)/dysfonction ventriculaire gauche
Des cas de diminution de la FEVG ont été rapportés lors du traitement par trametinib en association au dabrafenib à la fois chez des patients adultes et pédiatriques (voir la rubrique Effets indésirables). Dans les études cliniques chez les patients pédiatriques, le délai médian de survenue d'une diminution de la FEVG était d'environ un mois. Dans les études cliniques chez les patients adultes, le délai médian de survenue d'une dysfonction ventriculaire gauche, d'une insuffisance cardiaque, ou d'une diminution de la FEVG était entre 2 et 5 mois.
Le trametinib doit être utilisé avec prudence chez les patients présentant une altération de la fonction ventriculaire gauche. Les patients ayant une dysfonction ventriculaire gauche, de stade II, III ou IV selon la classification NYHA, ayant présenté un syndrome coronarien aigu dans les 6 derniers mois, une arythmie non contrôlée cliniquement significative et une hypertension artérielle non contrôlée ont été exclus des études cliniques ; la sécurité d'emploi dans cette population n'est donc pas connue.
Chez tous les patients, la FEVG doit être évaluée avant l'instauration du traitement, un mois après l'instauration du traitement, puis environ tous les 3 mois durant tout le traitement (voir la rubrique Posologie et mode d'administration pour les informations concernant les adaptations posologiques).
Chez les patients traités par trametinib en association au dabrafenib, des cas de dysfonctions aigues, sévères du ventricule gauche dus à une myocardite ont été rapportés occasionnellement. Une récupération complète a été observée à l'arrêt du traitement. Les médecins doivent être vigilants quant à la possibilité de survenue d'une myocardite chez les patients qui développent pour la première fois ou présentent une aggravation des signes ou symptômes cardiaques.
Pyrexie
Des cas de fièvre ont été rapportés dans les études cliniques évaluant le trametinib chez des patients adultes et pédiatriques (voir la rubrique Effets indésirables). L'incidence et la sévérité de la pyrexie ont été majorées avec le traitement en association (voir la rubrique Mises en garde spéciales et précautions d'emploi du RCP de dabrafenib en comprimés dispersibles). Chez les patients recevant le trametinib en association au dabrafenib, la pyrexie peut être associée à des frissons sévères, une déshydratation et une hypotension qui, dans certains cas, peut conduire à une insuffisance rénale aiguë. Chez les patients pédiatriques qui ont reçu le trametinib en association au dabrafenib, le délai médian de survenue de la pyrexie était de 1,5 mois.
Le traitement avec trametinib et dabrafenib doit être interrompu si la température corporelle du patient est ≥ 38°C (voir la rubrique Propriétés pharmacodynamiques). En cas de récurrence, le traitement peut également être interrompu au premier symptôme de pyrexie. Un traitement par antipyrétiques tels que l'ibuprofène ou le paracétamol doit être instauré. L'utilisation de corticostéroïdes par voie orale doit être envisagée dans le cas où les antipyrétiques s'avèrent insuffisants. Les patients doivent faire l'objet d'une surveillance en vue de détecter tout signe ou symptôme évocateur d'infection. Le traitement peut être repris dès lors que la fièvre a disparu. Si la fièvre est associée à d'autres signes et symptômes sévères, le traitement doit être redémarré à une dose réduite une fois l'épisode fébrile résolu et si l'état clinique du patient le permet (voir la rubrique Posologie et mode d'administration).
Modifications de la pression artérielle
Des hypertensions et des hypotensions ont été rapportées dans les études cliniques avec le trametinib en association au dabrafenib (voir la rubrique Effets indésirables). La pression artérielle doit être mesurée à l'instauration du traitement et surveillée pendant le traitement et la prise en charge d'une hypertension par un traitement standard est à envisager si nécessaire.
Pneumopathie interstitielle diffuse (PID)/pneumopathie
Dans une étude de phase III chez les patients adultes, 2,4 % (5/211) des patients traités par trametinib en monothérapie, ont développé une pneumopathie interstitielle diffuse ou une pneumopathie ; les 5 patients ont nécessité d'être hospitalisé. Le délai médian de survenue d'une PID ou d'une pneumopathie a été de 160 jours (entre 60 et 172 jours). Dans les deux études chez des patients adultes traités par le trametinib en association au dabrafenib, 1 % des patients ont développé une pneumopathie ou une PID (voir la rubrique Effets indésirables).
Le traitement par trametinib doit être suspendu chez les patients avec une suspicion de PID ou de pneumopathie, incluant des patients présentant de nouveaux signes et symptômes pulmonaires ou une progression de signes et symptômes préexistants, incluant une toux, une dyspnée, une hypoxie, un épanchement pleural ou des infiltrats pulmonaires, dans l'attente des résultats des investigations cliniques. Le trametinib doit être arrêté définitivement chez les patients ayant un diagnostic avéré de PID ou de pneumopathie associée au traitement (voir la rubrique Posologie et mode d'administration). Le traitement par dabrafenib peut être poursuivi à la même dose.
Troubles visuels
Des troubles, associés à des perturbations visuelles, tels qu'un décollement de l'épithélium pigmentaire de la rétine ou une occlusion de la veine rétinienne peuvent survenir lors du traitement par trametinib, dans certains cas avec un délai d'apparition de plusieurs mois. Des symptômes tels qu'une vision floue, une baisse de l'acuité visuelle et d'autres troubles visuels ont été rapportés dans les études cliniques réalisées avec le trametinib chez l'adulte. Au cours des études cliniques, des cas d'uvéite et d'iridocyclite ont aussi été rapportés chez des patients adultes et pédiatriques traités par trametinib en association au dabrafenib.
Le trametinib n'est pas recommandé chez les patients ayant des antécédents d'occlusion de la veine rétinienne. La sécurité d'emploi du trametinib n'a pas été établie chez des patients ayant des facteurs prédisposant à l'occlusion de la veine rétinienne, incluant un glaucome non contrôlé ou une hypertension oculaire, une hypertension artérielle non contrôlée, un diabète non contrôlé ou des antécédents de syndromes d'hyperviscosité ou hypercoagulabilité.
Un patient chez lequel survient un nouveau trouble de la vue, tel qu'une diminution de la vision centrale, une vision floue ou une perte de l'acuité visuelle durant le traitement par trametinib, devra être soumis rapidement à une évaluation ophtalmologique. Si un décollement de la rétine est diagnostiqué, les recommandations d'adaptation de posologie du tableau 4 doivent être suivies (voir la rubrique Posologie et mode d'administration) ; si une uvéite est diagnostiquée, veuillez vous référer au RCP de dabrafenib en comprimés dispersibles (rubrique Mises en garde spéciales et précautions d'emploi). Chez les patients pour lesquels une occlusion de la veine rétinienne est diagnostiquée, le traitement par trametinib doit être arrêté définitivement.
Aucune adaptation posologique de dabrafenib n'est requise lorsqu'il est pris en association au trametinib suite à un diagnostic d'occlusion de la veine rétinienne ou de décollement de l'épithélium pigmentaire de la rétine. En cas de survenue d'une uvéite, aucune adaptation posologique de trametinib n'est nécessaire lorsqu'il est administré en association au dabrafenib.
Eruption cutanée
Des éruptions cutanées ont été observées chez environ 49 % des patients pédiatriques au cours des études cliniques lorsque le trametinib est utilisé en association au dabrafenib (voir la rubrique Effets indésirables). Dans la majorité des cas, les éruptions étaient de grade 1 ou 2 et n'ont pas nécessité de réduction de posologie ou d'interruption du traitement.
Effets indésirables cutanés graves
Des cas d'effets indésirables cutanés graves incluant le syndrome de Stevens-Johnson, et la réaction d'hypersensibilité médicamenteuse avec éosinophilie et symptômes systémiques (DRESS pour Drug ReactionwithEosinophilia and SystemicSymptoms), pouvant menacer le pronostic vital ou être fatals, ont été rapportés lors de traitement par l'association trametinib/dabrafenib chez des patients adultes. Avant d'initier le traitement, les patients doivent être informés des signes et symptômes des réactions cutanées et être étroitement surveillés. Si des signes et symptômes évocateurs d'une réaction cutanée grave apparaissent, le dabrafenib et le trametinib doivent être arrêtés.
Rhabdomyolyse
Des cas de rhabdomyolyse ont été rapportés chez des patients adultes traités par trametinib. Dans certains cas, les patients ont pu poursuivre leur traitement par trametinib. Les cas les plus sévères ont nécessité une hospitalisation, une interruption ou l'arrêt définitif du traitement. Les signes ou symptômes d'une rhabdomyolyse doivent justifier une évaluation clinique appropriée et une prise en charge adaptée.
Pancréatite
Des cas de pancréatite ont été rapportés chez des patients adultes et pédiatriques traités par trametinib en association au dabrafenib lors des études cliniques (voir la rubrique Effets indésirables). Une douleur abdominale inexpliquée doit être rapidement investiguée par le dosage de l'amylase et la lipase sériques. Les patients doivent être étroitement surveillés lors de la reprise du traitement après un épisode de pancréatite.
Insuffisance rénale
Une insuffisance rénale a été identifiée chez ≤ 1 % des patients adultes traités par le trametinib en association au dabrafenib. Les cas observés chez les patients adultes étaient généralement associés à une pyrexie et une déshydratation et ont bien répondu à une interruption du traitement et à une prise en charge symptomatique. Des cas de néphrite granulomateuse ont également été rapportés chez les patients adultes. La créatininémie des patients doit être régulièrement surveillée durant le traitement.
Si la créatinine augmente, il peut être nécessaire d'interrompre le traitement selon le tableau clinique. Le trametinib n'a pas été étudié chez des patients ayant une insuffisance rénale (définie par une créatinine > 1,5 fois la valeur supérieure de la normale) ; en conséquence, la prudence est recommandée dans ce contexte (voir la rubrique Propriétés pharmacocinétiques).
Evènements hépatiques
Des effets indésirables hépatiques ont été rapportés dans les études cliniques réalisés chez les patients adultes et pédiatriques avec trametinib en association au dabrafenib (voir la rubrique Effets indésirables). Il est recommandé de surveiller la fonction hépatique des patients toutes les quatre semaines pendant les 6 premiers mois de traitement. La surveillance hépatique peut être poursuivie par la suite, selon la situation clinique.
Insuffisance hépatique
Le métabolisme hépatique et la sécrétion biliaire constituant les principales voies d'élimination du trametinib, le trametinib doit être administré avec prudence chez les patients présentant une insuffisance hépatique modérée à sévère (voir les rubriques Posologie et mode d'administration et Propriétés pharmacocinétiques).
Thrombose veineuse profonde/Embolie pulmonaire
Une embolie pulmonaire ou une thrombose veineuse profonde peut survenir. Si les patients développent des symptômes d'embolie pulmonaire ou de thrombose veineuse profonde tels qu'un essoufflement, une douleur thoracique, ou un gonflement des bras ou des jambes, ils doivent consulter immédiatement un médecin. Le traitement doit être arrêté définitivement en cas d'embolie pulmonaire mettant en jeu le pronostic vital.
Affections gastro-intestinales
Des cas de colites et d'entérocolites ont été rapportés chez les patients pédiatriques traités par trametinib en association au dabrafenib (voir la rubrique Effets indésirables). Des colites et perforations gastro-intestinales, parfois d'issue fatale, ont été rapportées chez des patients adultes. Le trametinib doit être administré avec précaution chez les patients présentant des facteurs de risque de perforation gastro-intestinale, notamment des antécédents de diverticulite, des métastases du tube digestif et en cas de prise concomitante de médicaments présentant un risque connu de perforation gastro-intestinale.
Sarcoïdose
Des cas de sarcoïdose ont été signalés chez des patients adultes traités par trametinib en association avec le dabrafenib, impliquant principalement la peau, les poumons, les yeux et les ganglions lymphatiques. Dans la majorité des cas, le traitement par trametinib et dabrafenib a été maintenu. En cas de diagnostic de sarcoïdose, il convient d'envisager un traitement approprié.
Femmes en âge de procréer/ Fertilité chez les hommes
Avant d'initier le traitement chez des femmes en âge de procréer, une information appropriée sur les méthodes de contraception efficaces doit être fournie. Les femmes en âge de procréer doivent utiliser des méthodes de contraception efficaces tout au long de leur traitement et durant les 16 semaines suivant la dernière prise de Spexotras. Les patients de sexe masculin traités par trametinib en association au dabrafenib doivent être informés du risque potentiel d'altération de la spermatogénèse, qui peut être irréversible (voir la rubrique Fertilité, grossesse et allaitement).
Lymphohistiocytose hémophagocytaire
Après la mise sur le marché, une lymphohistiocytosehémophagocytaire (LHH) a été observée chez des patients adultes traités par trametinib en association au dabrafenib. Il convient de faire preuve de prudence lorsque le trametinib est administré en association au dabrafenib. En cas de confirmation de LHH, l'administration de trametinib et de dabrafenib doit être interrompue, et un traitement de la LHH doit être instauré.
Syndrome de lyse tumorale (SLT)
La survenue d'un SLT, qui peut être fatal dans certains cas, a été observée chez les patients traités par du trametinib en association au dabrafenib (voir rubrique Effets indésirables). Les facteurs de risque de SLT comprennent une charge tumorale élevée, une insuffisance rénale chronique préexistante, une oligurie, une déshydratation, une hypotension et des urines acides. Les patients présentant des facteurs de risque de SLT doivent être étroitement surveillés et une hydratation prophylactique doit être envisagée. Les SLT sont à traiter rapidement, comme indiqué cliniquement.
Excipients
Sulfobutyle bétadex
de sodium
La solution
buvable de Spexotras contient de la cyclodextrinesulfobutylebétadex de sodium (100 mg/mL). Les cyclodextrines (CD) sont
des excipients qui peuvent influencer les propriétés de la substance active et
d'autres médicaments. Dans les études précliniques chez les animaux ayant reçu
des CD par voie intraveineuse, une toxicité rénale et une ototoxicité
ont été observées. Les aspects liés à l'innocuité des CD ont été pris en compte
lors du développement et de l'évaluation de l'innocuité du médicament. Il
n'existe que des données limitées de sécurité sur les effets des CD chez les
enfants de moins de 2 ans.
Parahydroxybenzoate de méthyle
Ce médicament
contient du parahydroxybenzoate de méthyle qui peut
provoquer des réactions allergiques (éventuellement retardées).
Sodium
Ce médicament
contient 1,98 mg de sodium par mL de solution buvable
de Spexotras, cela équivaut à 4 % de l'apport
alimentaire quotidien maximal recommandé par l'OMS pour un adulte à la dose
maximale quotidienne de 2 mg (40 mL) de trametinib.
Potassium
Ce médicament
contient moins de 1 mmol (39 mg) de potassium par
dose journalière maximale, c'est-à-dire qu'il est essentiellement « sans
potassium ».
Résumé du profil de sécurité
Dans les études cliniques pédiatriques avec trametinib en association au dabrafenib, les effets indésirables les plus fréquents (rapportés à une fréquence ≥ 20 %) ont été : la pyrexie (70 %), l'éruption cutanée (49 %), la céphalée (47 %), les vomissements (40 %), la fatigue (36 %), la sécheresse de la peau (35 %), la diarrhée (34 %), les hémorragies (34 %), la nausée (29 %), la dermatite acnéiforme (29 %), les douleurs abdominales (28 %), la neutropénie (26 %), la toux (24 %) et l'augmentation des transaminases (22 %). Les effets indésirables graves (grade 3/4) les plus fréquemment rapportés étaient : la neutropénie (15 %), la pyrexie (11 %), l'augmentation des transaminases (6 %) et la prise de poids (5 %). Les données à long terme sur la croissance et la maturation du squelette chez les patients pédiatriques sont actuellement limitées (voir la rubrique Données de sécurité préclinique).
Le profil de sécurité chez les patients pédiatriques était en grande partie cohérent avec le profil de sécurité précédemment établi chez les patients adultes. Les effets indésirables supplémentaires suivants n'ont été rapportés jusqu'à présent que chez des patients adultes traités par trametinib en comprimés et dabrafenib en gélules : carcinome épidermoïde cutané, kératose séborrhéique, neuropathie périphérique (dont neuropathie sensorielle et motrice), lymphœdème, sécheresse buccale, kératose actinique, insuffisance rénale (fréquent), mélanome, acrochordon, sarcoïdose, choriorétinopathie, pneumonie, insuffisance rénale aigue, néphrite, insuffisance cardiaque, dysfonction ventriculaire gauche, pneumopathie interstitielle diffuse, rhabdomyolyse (peu fréquent), perforation gastro-intestinale, lymphohistiocytose hémophagocytaire (rare), syndrome de lyse tumorale, myocardite, syndrome de Stevens-Johnson, réaction médicamenteuse avec éosinophilie et symptômes systémiques (fréquence indéterminée).
Liste tabulée des effets indésirables
Le profil de sécurité de l'association trametinib au dabrafenib a été évaluée à partir d'une analyse poolée de 171 patients pédiatriques, comprenant deux études menées chez des patients atteints de tumeurs solides avancées présentant une mutation BRAF V600. Quatre patients (2,3 %) étaient âgés de 1 à < 2 ans, 39 patients (22,8 %) étaient âgés de 2 à < 6 ans, 54 patients (31,6 %) étaient âgés de 6 à < 12 ans et 74 patients (43,3 %) étaient âgés de 12 à < 18 ans au moment du recrutement. La durée moyenne du traitement était de 2,3 ans.
Les effets indésirables (tableau 5) sont listés ci-dessous par classe de système d'organes MedDRA classées par fréquence et utilisant la convention suivante : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000), très rare (< 1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Au sein de chaque groupe de fréquence, les effets indésirables sont présentés en ordre décroissant de gravité.
Tableau 5 Effets indésirables sous trametinib en association au dabrafenib
|
Infections et infestations |
|
|
Très fréquent |
Paronychie, rhinopharyngite*1 |
|
Fréquent |
Infection urinaire, cellulite |
|
Tumeurs bénignes, malignes et non précisées (incluant les kystes et polypes) |
|
|
Très fréquent |
Papillome cutané |
|
Affections hématologiques et du système lymphatique |
|
|
Très fréquent |
Neutropenie*2, anémie, leucopénie* |
|
Fréquent |
Thrombocytopénie* |
|
Affections du système immunitaire |
|
|
Fréquent |
Hypersensibilité |
|
Troubles du métabolisme et de la nutrition |
|
|
Fréquent |
Déshydratation, diminution de l'appétit |
|
Affections du système nerveux |
|
|
Très fréquent |
Céphalée, sensations vertigineuses*3 |
|
Affections oculaires |
|
|
Fréquent |
Vision floue, trouble de l'acuité visuelle, uvéite*4 |
|
Peu fréquent |
Décollement de la rétine, œdème périorbitaire |
|
Affections cardiaques |
|
|
Fréquent |
Fraction d'éjection diminuée, bradycardie* |
|
Peu fréquent |
Bloc auriculoventriculaire5 |
|
Affections vasculaires |
|
|
Très fréquent |
Hémorragie*6 |
|
Fréquent |
Hypertension, hypotension |
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Très fréquent |
Toux* |
|
Fréquent |
Dyspnée |
|
Affections gastro-intestinales |
|
|
Très fréquent |
Douleur abdominale*, constipation, diarrhée, nausée, vomissement |
|
Fréquent |
Pancréatite, stomatite |
|
Peu fréquent |
Colite* |
|
Affections de la peau et du tissu sous-cutané |
|
|
Très fréquent |
Dermatite acnéiforme*7, sécheresse cutanée*8, prurit, éruption cutanée*9, érythème |
|
Fréquent |
Dermatite exfoliative généralisée*10, alopécie, syndrome d'érythrodysesthésie palmo-plantaire, folliculite, lésion cutanée, panniculite, hyperkératose, photosensibilité*11 |
|
Peu fréquent |
Dermatose aiguë fébrile neutrophilique, fissures cutanées, sueurs nocturnes, hyperhidrose |
|
Affections musculo-squelettiques et systémiques |
|
|
Très fréquent |
Arthralgie, douleur des extrémités |
|
Fréquent |
Myalgie*, spasmes musculaires*12 |
|
Troubles généraux et anomalies au site d'administration |
|
|
Très fréquent |
Pyrexie*, fatigue*13, prise de poids |
|
Fréquent |
Inflammation des muqueuses, œdème du visage*, frissons, œdème périphérique, syndrome pseudo-grippal |
|
Investigations |
|
|
Très fréquent |
Augmentation des transaminases*14 |
|
Fréquent |
Hyponatrémie, hypophosphatémie, hyperglycémie, augmentation des phosphatases alcalines sanguines, augmentation des gamma GT, augmentation de la créatine phosphokinase sérique (CPK) |
|
*Désigne un groupe de deux termes préférés MedDRA ou plus qui étaient considérés comme cliniquement similaires. 1 la rhinopharyngite comprend également la pharyngite 2
la
neutropénie comprend également la diminution du nombre de neutrophiles et la
neutropénie fébrile 3 les sensations vertigineuses comprennent également le vertige 4 l'uvéite comprend également l'iridocyclite 5 le bloc auriculoventriculaire inclut le bloc auriculoventriculaire de premier degré 6 l'hémorragie comprend également l'épistaxis, l'hématurie, la contusion, l'hématome, l'augmentation du rapport international normalisé (INR), l'hémorragie anale, l'hémorragie au niveau du cathéter, l'hémorragie cérébrale, l'ecchymose, l'hématome extradural, l'hémorragie gastro-intestinale, l'hématochézie (rectorragie), les pétéchies, l'hémorragie post-procédure, l'hémorragie rectale, la diminution du nombre de globules rouges, l'hémorragie gastro-intestinale haute, l'hémorragie utérine, les saignements menstruels abondants et le purpura 7
la
dermatite acnéiforme comprend également l'acné et l'acné pustuleuse 8 la sécheresse cutanée comprend également la xérose et la xérodermie 9 l'éruption cutanée comprend également l'éruption maculo-papulaire, l'éruption pustuleuse, l'éruption érythémateuse, l'éruption papuleuse, l'éruption maculaire 10 la dermatite exfoliative généralisée comprend également l'exfoliation de la peau et la dermatite exfoliative 11 la photosensibilité comprend la réaction de photosensibilité et les coups de soleil 12 les spasmes musculaires comprennent également la raideur musculo-squelettique 13 la fatigue comprend également le malaise et l'asthénie 14 l'augmentation des transaminases, y compris augmentation de l'aspartate aminotransférase (ASAT), de l'alanine aminotransférase (ALAT) et l'hypertransaminasémie |
|
Description de certains effets indésirables
Prise de poids
La prise de poids a été rapportée
uniquement dans la population pédiatrique. Elle a été rapportée comme un effet
indésirable chez 16 % des patients pédiatriques dont 5 % étaient de grade 3,
avec un arrêt de traitement chez 0,6 % des patients. Le délai médian de
survenue de la prise de poids chez les patients pédiatriques recevant le
trametinib en association au dabrafenib était de 3,5 mois. Une augmentation du
poids par rapport à la valeur initiale de ≥ 2 catégories de percentiles de
l'IMC (indice de masse corporelle) pour l'âge a été observée chez 36 % des
patients.
Hémorragie
Des évènements hémorragiques ont
été observés chez 34 % des patients pédiatriques, avec des événements de grade
3 survenant chez 1,2 % des patients. L'événement hémorragique le plus fréquent
(épistaxis) a été rapporté chez 18 % des patients pédiatriques. Le délai médian
de survenue de l'événement hémorragique chez les patients pédiatriques était de
2,6 mois. Des événements hémorragiques, pour certains majeurs et des
hémorragies d'issue fatale, sont survenus chez les patients adultes traités par
trametinib en association au dabrafenib.
Le risque hémorragique peut être majoré par l'utilisation concomitante de médicaments antiplaquettaires ou anticoagulants. En cas d'hémorragie, les patients doivent être traités en fonction de la situation clinique (voir la rubrique Mises en garde spéciales et précautions d'emploi).
Réduction de la fraction d'éjection du
ventricule gauche (FEVG) / dysfonction ventriculaire gauche
Des diminutions de la FEVG ont été rapportées chez 5,3 % des patients
pédiatriques, dont moins de 1 % de grade 3. Le délai médian
de survenue de réduction de la FEVG était d'environ 1 mois. Dans les études
cliniques chez les patients adultes, le délai médian d'apparition d'une
dysfonction ventriculaire gauche, d'une insuffisance cardiaque ou d'une
diminution de la FEVG a été d'environ 2 à 5 mois.
Les patients présentant une FEVG inférieure à la valeur de la limite inférieure de la normale institutionnelle n'ont pas été inclus dans les études cliniques avec trametinib. Le trametinib en association au dabrafenib doit être utilisé avec prudence chez les patients présentant des pathologies susceptibles d'affecter la fonction ventriculaire gauche (voir les rubriques Posologie et mode d'administration et Mises en garde spéciales et précautions d'emploi).
Pyrexie
La survenue d'une pyrexie a été
rapportée au cours des études cliniques avec le trametinib en monothérapie et
en association au dabrafenib. Cependant, l'incidence et la sévérité de la
pyrexie étaient majorées avec l'association (voir la rubrique Mises en garde spéciales et précautions d'emploi). Une pyrexie
a été rapportée chez 70 % des patients pédiatriques, avec des événements de
grade 3 survenant chez 11 % des patients. Veuillez vous référer au RCP du
dabrafenib en comprimés dispersibles.
Evènements hépatiques
Des effets indésirables
hépatiques ont été rapportés chez les patients adultes et pédiatriques dans les
études cliniques réalisées avec le trametinib en association au dabrafenib.
Dans la population de sécurité pédiatrique, une augmentation des ALAT et des
ASAT étaient très fréquentes, rapportées chez 13 % et 16 % des patients,
respectivement (voir la rubrique Mises en garde spéciales et précautions d'emploi). Les effets
indésirables hépatiques, augmentation des ALAT et augmentation des ASAT
ont été les événements hépatiques les plus fréquents dans la population adulte
et la majorité était de Grade 1 ou 2. Pour le trametinib en monothérapie, plus
de 90 % de ces évènements hépatiques sont survenus dans les 6 premiers mois de
traitements. Les évènements hépatiques ont été détectés dans les études cliniques
par une surveillance biologique toutes les 4 semaines. Il est recommandé pour
les patients recevant trametinib de réaliser une surveillance de la fonction
hépatique toutes les 4 semaines pendant les 6 premiers mois. La surveillance
hépatique peut être poursuivie au-delà en cas d'indication clinique (voir la
rubrique Mises en garde spéciales et précautions d'emploi).
Modifications de la pression artérielle
Une hypertension a été rapportée
chez 2,3 % des patients pédiatriques, dont des grades 3 survenus chez 1,2 % des
patients. Le délai médian d'apparition de l'hypertension chez les patients
pédiatriques était de 5,4 mois.
Une hypotension a été rapportée chez 4,1 % des patients pédiatriques, avec des événements de grade 3 et plus survenant chez 2,3 % des patients. Le délai médian d'apparition d'une hypotension chez les patients pédiatriques était de 2,2 mois.
La pression artérielle doit être mesurée à l'instauration du traitement et surveillée pendant le traitement, et la prise en charge d'une hypertension par un traitement standard est à envisager, si nécessaire (voir la rubrique Mises en garde spéciales et précautions d'emploi).
Pneumopathie interstitielle diffuse
(PID)/Pneumopathie
Les patients traités par
trametinib sont susceptibles de développer une PID ou une pneumopathie. Le
traitement par trametinib doit être suspendu chez les patients pour lesquels
une PID ou une pneumopathie est suspectée, incluant les patients présentant de
nouveaux signes ou symptômes pulmonaires ou une progression de signes ou symptômes
préexistants tels qu'une toux, une dyspnée, une hypoxie, un épanchement pleural
ou des infiltrats pulmonaires, dans l'attente des résultats des investigations
cliniques. Le traitement par trametinib doit être définitivement arrêté chez
les patients avec un diagnostic avéré de PID ou de pneumopathie associée au
traitement (voir les rubriques Posologie et mode d'administration et Mises en garde spéciales et précautions d'emploi).
Troubles visuels
Des réactions ophtalmologiques
ont été rapportés chez des patients pédiatriques traités par trametinib en
association au dabrafenib, incluant des uvéites (3,5 %) et des iridocyclites
(1,8 %). Des uvéites de grade 3 sont survenues chez < 1,8 % des patients
pédiatriques. Un décollement de l'épithélium pigmentaire de la rétine est
survenu chez < 1 % des patients pédiatriques. Des troubles, associés à des
perturbations visuelles, tels qu'un décollement de l'épithélium pigmentaire de
la rétine ou une occlusion de la veine rétinienne ont également été observés
chez des patients adultes. Des symptômes tels qu'une vision floue, une baisse de
l'acuité visuelle et d'autres troubles visuels ont été rapportés dans les
études cliniques réalisées avec le trametinib (voir les rubriques Posologie et mode d'administration et Mises en garde spéciales et précautions d'emploi).
Eruption cutanée
Une éruption cutanée a été
observée chez 49 % des patients pédiatriques dans les études avec l'association
du trametinib au dabrafenib dans la population totale des études poolées pour
l'analyse de sécurité. Dans la majorité des cas, les éruptions étaient de grade
1 ou 2 et n'ont pas nécessité d'interruption du traitement ou de réduction de
posologie (voir les rubriques Posologie et mode d'administration et Mises en garde spéciales et précautions d'emploi).
Rhabdomyolyse
Des cas de rhabdomyolyse ont été
rapportés chez des patients adultes traités par trametinib. Les signes ou
symptômes d'une rhabdomyolyse doivent justifier une évaluation clinique
appropriée et une prise en charge adaptée (voir la rubrique Mises en garde spéciales et précautions d'emploi).
Pancréatite
Des cas de pancréatite ont été
rapportés chez 1,2 % des patients pédiatriques, dont moins de 1 % était de
grade 3. Toute douleur abdominale inexpliquée doit être investiguée, en incluant
un dosage de l'amylase et de la lipase sériques. Les patients doivent être
étroitement surveillés lors de la reprise du traitement après un épisode de
pancréatite (voir la rubrique Mises en garde spéciales et précautions d'emploi).
Insuffisance rénale
Une insuffisance rénale a été
rapportée avec le trametinib en association au dabrafenib. Une insuffisance
rénale due à une azotémie extra-rénale associée à la pyrexie ou à une néphrite
granulomateuse s'est révélée peu fréquente chez les patients adultes ;
toutefois, le dabrafenib n'a pas été étudié chez les patients ayant une
insuffisance rénale (définie par une créatinine > 1,5 fois la valeur
supérieure de la normale). La prudence est recommandée dans cette situation
(voir la rubrique Mises en garde spéciales et précautions d'emploi).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration - voir Annexe V.
AVANT
la mise en route du traitement : confirmer par un test validé que le
patient est bien atteint d'une tumeur avec la mutation BRAF V600E.
SURVEILLANCE DU TRAITEMENT :
- Cardiaque : la FEVG doit être évaluée avant l'instauration du
traitement, un mois après, puis environ tous les 3 mois durant le
traitement.
- Tensionnelle : la pression artérielle doit être mesurée à l'instauration du traitement et pendant le traitement.
- Créatinine sérique.
- Hépatique : la fonction hépatique doit être surveillée toutes les 4
semaines pendant les 6 premiers mois de traitement puis selon la
situation clinique.
- Cutanée avant l'initiation du traitement, puis mensuellement pendant le traitement et jusqu'à 6 mois après le traitement.
De nouveaux mélanomes primitifs ont été rapportés chez les patients recevant trametinib en association au dabrafenib.
INFORMER LES PATIENTS :
- des signes et symptômes des réactions cutanées ;
- du risque potentiel de fatigue, de sensations vertigineuses ou de
problèmes oculaires affectant l'aptitude à conduire des véhicules et à
utiliser des machines.
IINFORMER
le médecin dès que possible en cas d'une modification de la peau de
l'enfant telle qu'une nouvelle verrue, une plaie cutanée ou une
excroissance rougeâtre qui saigne ou qui ne cicatrise pas, ou un
changement de la taille ou de la couleur d'un grain de beauté.
ARRETER le traitement et CONSULTER en urgence en médecin si l'enfant traité présente l'un des symptômes suivants :
- Toux avec expectorations de sang, présence de sang dans les urines,
vomissements contenant du sang ou ayant l'apparence de "café moulu",
selles de couleur rouge ou noire ayant l'apparence du goudron.
- Fièvre (température supérieure ou égale à 38 °C).
- Douleurs thoraciques ou essoufflement, parfois associés à de la fièvre ou de la toux.
- Vision trouble, perte de vision ou autres changements de la vision.
- Yeux rouges, douleurs oculaires, sensibilité accrue à la lumière.
- Douleurs musculaires inexpliquées, crampes musculaires ou faiblesse musculaire, urine foncée.
- Fortes douleurs abdominales.
- Fièvre, ganglions lymphatiques gonflés, ecchymoses ou éruptions cutanées en même temps.
- Nausées, essoufflement, rythme cardiaque irrégulier, crampes
musculaires, crises d'épilepsie, urines troubles, diminution du volume
des urines et fatigue.
- Plaques rougeâtres sur le tronc qui sont circulaires ou en forme de
cibles, avec ou sans vésicules centrales, desquamation de la peau,
ulcérations de la bouche, de la gorge, du nez, des organes génitaux et
des yeux.
PRUDENCE en cas de conduite de véhicules ou d'utilisation de machines
(risque potentiel de fatigue, de sensations vertigineuses ou de
problèmes oculaires).
FEMME en âge de PROCREER : utiliser des méthodes de contraception
efficaces (méthodes contraceptives barrières) pendant toute la durée du
traitement et durant les 16 semaines suivant la dernière prise de ce
traitement.
Femmes en âge de procréer/Contraception chez les femmes
Les femmes en âge de procréer doivent utiliser des méthodes de contraception efficaces pendant le traitement par trametinib, et durant les 16 semaines suivant l'arrêt du traitement.
L'utilisation en association au dabrafenib peut diminuer l'efficacité des contraceptifs hormonaux oraux ou administrés par voie systémique et une méthode alternative efficace de contraception, telle qu'une méthode contraceptive barrière, doit être utilisée pendant le traitement par l'association trametinib/dabrafenib. Veuillez-vous référer au RCP du dabrafenib en comprimés dispersibles pour plus d'informations.
Grossesse
Il n'existe pas de données sur l'utilisation du trametinib chez la femme enceinte. Les études réalisées chez l'animal ont montré une toxicité sur la reproduction (voir la rubrique Données de sécurité préclinique). Le trametinib ne doit pas être administré aux femmes enceintes à moins que le bénéfice potentiel pour la mère ne l'emporte sur le risque possible pour le fœtus. Si le trametinib est utilisé pendant la grossesse ou dans le cas où une grossesse surviendrait pendant le traitement par trametinib, la patiente devra être informée du risque potentiel pour le fœtus.
Allaitement
Le passage du trametinib dans le lait maternel n'est pas connu. Un risque pour l'enfant allaité ne peut être exclu. Le trametinib ne doit pas être administré chez les mères allaitant. La décision d'interrompre soit l'allaitement soit le traitement par le trametinib devra prendre en compte le bénéfice de l'allaitement pour l'enfant au regard du bénéfice du traitement pour la mère.
Fertilité
Aucune donnée n'est disponible chez l'être humain pour le trametinib. Chez l'animal, aucune étude sur la fertilité n'a été réalisée mais des effets ont été observés au niveau des organes reproducteurs féminins (voir la rubrique Données de sécurité préclinique). Le trametinib peut altérer la fertilité chez les humains.
Pour les hommes traités par trametinib en association au dabrafenib
Des effets sur la spermatogénèse ont été observés chez les animaux traités par le dabrafenib. Les patients de sexe masculin prenant trametinib en association au dabrafenib doivent être informés du risque potentiel d'une atteinte de la spermatogénèse, qui peut être irréversible. Pour plus d'informations, veuillez-vous référer au RCP du dabrafenib en comprimés dispersibles.
Les études d'interaction n'ont été réalisées que chez l'adulte.
Effets d'autres médicaments sur le trametinib
Le trametinib étant principalement métabolisé par une désacétylation induite par des enzymes hydrolytiques (par exemple les carboxylestérases), ses caractéristiques pharmacocinétiques sont peu susceptibles d'être modifiées par d'autres agents via des interactions métaboliques (voir la rubrique Propriétés pharmacocinétiques). Des interactions entre médicaments médiées par ces enzymes hydrolytiques ne peuvent être exclues et pourraient avoir un impact sur l'exposition au trametinib.
Le trametinib est un substrat du transporteur d'efflux P-gp in vitro. Comme il ne peut être exclu qu'une forte inhibition de la P-gp hépatique puisse résulter en une augmentation de l'exposition au trametinib, une attention particulière est recommandée lorsque trametinib est administré en association à d'autres médicaments qui sont de puissants inhibiteurs de la P-gp (par exemple vérapamil, cyclosporine, ritonavir, quinidine, itraconazole).
Effets du trametinib sur d'autres médicaments
Sur la base des données in vitro et in vivo, le trametinib est peu susceptible de modifier significativement les caractéristiques pharmacocinétiques d'autres médicaments via les enzymes ou les transporteurs du CYP (voir la rubrique Propriétés pharmacocinétiques). Le trametinib peut entraîner une inhibition transitoire des substrats du BCRP (par exemple : pitavastatine) au niveau intestinal, qui peut toutefois être minimisée par une répartition appropriée des prises (respect d'un intervalle de 2 heures) de ces médicaments et du trametinib.
Sur la base de données cliniques, aucune perte d'efficacité des contraceptifs hormonaux n'est attendue lorsqu'ils sont administrés concomitamment au trametinib (voir la rubrique Propriétés pharmacocinétiques). Cependant, l'utilisation avec le dabrafenib peut rendre les contraceptifs hormonaux moins efficaces.
Effet de l'excipient sulfobutyle bétadex de sodium sur d'autres médicaments par voie orale, à faible biodisponibilité et avec une marge thérapeutique étroite
La solution buvable de trametinib contient 100 mg/ml de sulfobutyle bétadex de sodium pouvant avoir un effet sur la solubilité et la biodisponibilité d'autres médicaments pris par voie orale. Il faut être prudent lorsque la solution buvable de trametinib est administrée avec des médicaments par voie orale qui ont une faible biodisponibilité et une marge thérapeutique étroite (ex. imipramine, désipramine).
Veuillez vous reporter également aux recommandations sur les interactions médicamenteuses pour le dabrafenib figurant dans les rubriques Mises en garde spéciales et précautions d'emploi et Interactions avec d'autres médicaments et autres formes d'interactions du RCP de dabrafenib en comprimés dispersibles.
Le traitement par Spexotras doit être initié et supervisé par un médecin expérimenté dans l'utilisation des traitements anticancéreux.
Avant de prendre Spexotras, les patients doivent avoir la confirmation de la présence de la mutation BRAF V600E par un dispositif médical de diagnostic in vitro (DIV) portant le marquage CE prévu pour cet usage. Si un DIV portant le marquage CE n'est pas disponible, la confirmation de la présence de la mutation BRAF V600E doit être déterminée par un autre test validé.
Spexotras est utilisé en association au dabrafenib en comprimés dispersibles. Veuillez vous référer au Résumé des Caractéristiques du Produit (RCP) pour la posologie du dabrafenib en comprimés dispersibles.
Posologie
La dose recommandée en une prise par jour de Spexotras est déterminée selon le poids (tableau 1).
Tableau 1 Schéma posologique en fonction du poids
|
Poids* |
Dose recommandée |
|
|
Volume de solution buvable (mL) en une prise par jour |
correspondant en mg de trametinib |
|
|
8 kg |
6 mL |
0.30 mg |
|
9 à 10 kg |
7 mL |
0.35 mg |
|
11 kg |
8 mL |
0.40 mg |
|
12 à 13 kg |
9 mL |
0.45 mg |
|
14 à 17 kg |
11 mL |
0.55 mg |
|
18 à 21 kg |
14 mL |
0.70 mg |
|
22 à 25 kg |
17 mL |
0.85 mg |
|
26 à 29 kg |
18 mL |
0.90 mg |
|
30 à 33 kg |
20 mL |
1 mg |
|
34 à 37 kg |
23 mL |
1.15 mg |
|
38 à 41 kg |
25 mL |
1.25 mg |
|
42 à 45 kg |
28 mL |
1.40 mg |
|
46 à 50 kg |
32 mL |
1.60 mg |
|
≥51 kg |
40 mL |
2 mg |
|
*Arrondir le poids au kg le plus proche, si nécessaire. La dose recommandée pour les patients pesant moins de 8 kg n'a pas été établie. Veuillez vous référer aux rubriques « Posologie » et « Mode d'administration » du RCP du dabrafenib en comprimés dispersibles pour les instructions sur la prise du traitement par dabrafenib lorsqu'il est utilisé en association avec Spexotras. |
||
Durée du traitement
Le traitement par Spexotras doit
être poursuivi jusqu'à progression de la maladie ou la survenue d'une toxicité
inacceptable. Il existe des données limitées chez les patients âgés de plus de
18 ans atteints de gliome, par conséquent la poursuite du traitement à l'âge
adulte devra être décidée en fonction du rapport bénéfice/risque individuel
évalué par le médecin.
Omission ou retard d'administration d'une dose
Si une dose de Spexotras est
oubliée, elle ne doit être prise que s'il reste plus de 12 heures avant la
prochaine prise prévue. Si le patient vomit après avoir pris une dose de
Spexotras, une dose supplémentaire ne doit pas être prise et la dose suivante
doit être prise à l'heure prévue.
Adaptations posologiques
La prise en charge des effets
indésirables peut nécessiter une réduction de dose, une interruption temporaire
du traitement ou un arrêt du traitement (voir tableaux 2 et 3).
Si des toxicités liées au traitement surviennent, alors les posologies de trametinib et de dabrafenib doivent simultanément être réduites, interrompues ou arrêtées. Les exceptions pour lesquelles des adaptations posologiques sont nécessaires pour un seul des deux traitements sont détaillées ci-dessous pour l'uvéite, les tumeurs malignes non cutanées ayant une mutation RAS (toxicités principalement liées au dabrafenib), la réduction de la fraction d'éjection du ventricule gauche (FEVG), l'occlusion de la veine rétinienne (OVR), le décollement de l'épithélium pigmentaire de la rétine (DEP), et la maladie pulmonaire interstitielle/pneumopathie (toxicités principalement liées au trametinib).
Il n'est pas recommandé d'effectuer des adaptations posologiques ou d'interrompre le traitement en cas de survenue d'effets indésirables de type tumeur maligne cutanée (voir le RCP de dabrafenib en comprimés dispersibles pour plus de détails).
Tableau 2 Schéma d'adaptation posologique selon le grade des effets indésirables (excepté pour la pyrexie)
|
Grade (CTCAE)* |
Recommandations de modifications de la posologie du trametinib |
|
Grade 1 ou Grade 2 (Tolérable) |
Maintien de la dose et surveillance clinique appropriée. |
|
Grade 2 (Intolérable) ou Grade 3 |
Interruption
du traitement jusqu'au retour à la normale ou à une toxicité de Grade 1 et
reprise du traitement à une dose réduite d'un palier. Se référer au Tableau 3 pour les adaptations posologiques. |
|
Grade 4 |
Arrêt définitif ou interruption du traitement jusqu'au
retour à la normale ou à un Grade 1 et reprise du traitement à une dose réduite d'un palier. Se référer au Tableau 3 pour les adaptations posologiques. |
|
*L'intensité
des effets indésirables cliniques est cotée selon les critères communs de
terminologie pour les événements indésirables (Common Terminology Criteria for Adverse Events ; CTCAE). |
|
Les recommandations de réductions de doses à environ 75 % de la dose recommandée (premier niveau de réduction de dose) et à environ 50 % de la dose recommandée (second niveau de réduction de dose) sont présentées dans le tableau 3.
Tableau 3 Recommandations de diminution de la posologie en cas d'effets indésirables
|
Poids |
Dose recommandée |
Dose réduite |
|
|
mL de solution (mg de trametinib) (une prise par jour) |
Dose après la première réduction (une fois par jour) |
Dose après la seconde réduction (une fois par jour) |
|
|
8 kg |
6 mL (0.30 mg) |
5 mL |
3 mL |
|
9 à 10 kg |
7 mL (0.35 mg) |
5 mL |
4 mL |
|
11 kg |
8 mL (0.40 mg) |
6 mL |
4 mL |
|
12 à 13 kg |
9 mL (0.45 mg) |
7 mL |
5 mL |
|
14 à 17 kg |
11 mL (0.55 mg) |
8 mL |
6 mL |
|
18 à 21 kg |
14 mL (0.70 mg) |
11 mL |
7 mL |
|
22 à 25 kg |
17 mL (0.85 mg) |
13 mL |
9 mL |
|
26 à 29 kg |
18 mL (0.90 mg) |
14 mL |
9 mL |
|
30 à 33 kg |
20 mL (1 mg) |
15 mL |
10 mL |
|
34 à 37 kg |
23 mL (1.15 mg) |
17 mL |
12 mL |
|
38 à 41 kg |
25 mL (1.25 mg) |
19 mL |
13 mL |
|
42 à 45 kg |
28 mL (1.40 mg) |
21 mL |
14 mL |
|
46 à 50 kg |
32 mL (1.60 mg) |
24 mL |
16 mL |
|
≥51 kg |
40 mL (2 mg) |
30 mL |
20 mL |
|
Un ajustement posologique de
Spexotras inférieur à 50% de la dose recommandée n'est pas recommandé. |
|||
Lorsque les effets indésirables d'un patient sont bien pris en charge, une ré-augmentation de dose peut être envisagée, en respectant les paliers utilisés au moment de la réduction de la dose. La posologie de trametinib ne doit pas excéder les doses recommandées dans le tableau 1.
Modifications de la posologie en cas d'effets indésirables
particuliers
Pyrexie
Si la température corporelle du
patient est ≥ 38oC, le traitement avec trametinib et dabrafenib doit
être interrompu. En cas de récurrence, le traitement peut également être
interrompu au premier symptôme de pyrexie. Un traitement par antipyrétiques
tels que l'ibuprofène ou le paracétamol doit être instauré. L'utilisation de
corticostéroïdes par voie orale doit être envisagée dans le cas où les antipyrétiques
s'avèrent insuffisants. Des signes et symptômes d'infection doivent être
recherchés et si nécessaire, les patients doivent être traités conformément aux
pratiques locales (voir rubrique Mises en garde spéciales et précautions d'emploi). Le traitement est à reprendre si le
patient n'a pas eu de symptôme pendant au moins 24 heures, soit (1) à la même
dose, soit (2) au palier de dose inférieur, si la fièvre est récurrente et/ou
était accompagnée d'autres symptômes sévères dont une déshydratation, une
hypotension ou une insuffisance rénale.
Exceptions concernant les modifications de posologie (lorsque la
réduction de dose s'applique uniquement
pour un des deux traitements) spécifiques à certains effets indésirables
Diminution de la fraction
d'éjection du ventricule gauche (FEVG)/Dysfonction ventriculaire gauche
Le
traitement par trametinib doit être interrompu chez les patients présentant de
façon asymptomatique une diminution absolue > 10 % de la fraction d'éjection
du ventricule gauche par rapport à la valeur initiale et avec une valeur de la
fraction d'éjection inférieure à la limite inférieure de la normale
institutionnelle (voir la rubrique Mises en garde spéciales et précautions d'emploi). Lorsque le dabrafenib est pris en
association avec le trametinib, aucune adaptation posologique de dabrafenib
n'est requise. Si la fraction d'éjection ventriculaire gauche se rétablit, le
traitement par trametinib peut être repris mais à une dose réduite d'un palier
et sous surveillance clinique étroite (voir la rubrique Mises en garde spéciales et précautions d'emploi).
Le traitement par le trametinib doit être définitivement arrêté chez les patients qui présentent une dysfonction ventriculaire gauche de Grade 3 ou 4 ou une réduction cliniquement significative de la fraction d'éjection ventriculaire gauche qui ne s'est pas rétablie dans un délai de 4 semaines (voir la rubrique Mises en garde spéciales et précautions d'emploi).
Occlusion de la
veine rétinienne et décollement de l'épithélium pigmentaire de la rétine
Si les patients signalent
l'apparition d'un trouble de la vision, comme une diminution de la vision
centrale, une vision floue ou une perte de l'acuité visuelle durant le
traitement par trametinib en association au dabrafenib, une évaluation
ophtalmologique doit être rapidement réalisée. Le traitement par trametinib
doit être arrêté définitivement si une occlusion de la veine rétinienne est
diagnostiquée durant le traitement. Si un décollement de l'épithélium
pigmentaire de la rétine (décollement de la rétine) est diagnostiqué durant le
traitement, suivre les modifications de posologie du trametinib indiquées dans
le tableau 4 (voir la rubrique Mises en garde spéciales et précautions d'emploi). Pour les cas confirmés d'occlusion de la
veine rétinienne ou de décollement de l'épithélium pigmentaire de la rétine,
aucune adaptation posologique de dabrafenib n'est requise lorsqu'il est pris en
association au trametinib.
Tableau 4 Recommandations d'adaptation posologique du trametinib en cas de décollement de la rétine
|
Décollement de la rétine Grade 1 |
Poursuivre le traitement avec une évaluation mensuelle de la rétine jusqu'à résolution du décollement. Si le décollement de la rétine
s'aggrave, suivre les instructions ci-dessous et suspendre le traitement par trametinib jusqu'à 3 semaines |
|
Décollement de la rétine Grade 2 ou 3 |
Suspendre le traitement par trametinib jusqu'à 3 semaines |
|
Décollement de la rétine Grade 2 ou 3 revenant à la normale ou à un Grade 1 en 3 semaines |
Reprendre le traitement par trametinib à une posologie plus faible (voir tableau 3) ou arrêter le traitement par trametinib chez les patients recevant la posologie la plus faible. |
|
Décollement de la rétine Grade 2 ou 3 sans retour à la normale ou à un Grade 1 en 3 semaines |
Arrêt définitif du traitement par trametinib |
Pneumopathie
interstitielle diffuse (PID)/Pneumopathie
Le traitement par trametinib doit
être suspendu chez les patients pour lesquels une pneumopathie interstitielle
diffuse (PID) ou une pneumopathie est suspectée, incluant les patients
présentant de nouveaux symptômes et signes pulmonaires ou une progression de
symptômes et signes préexistants incluant une toux, une dyspnée, une hypoxie,
un épanchement pleural ou des infiltrats pulmonaires, dans l'attente des
résultats des investigations cliniques. Le traitement par trametinib doit être
définitivement arrêté chez les patients avec un diagnostic avéré de PID ou de
pneumopathie associée au traitement. Aucune adaptation de posologie de
dabrafenib n'est requise lorsqu'il est pris en association au trametinib en cas
de PID ou de pneumopathie.
Uvéite
Aucune adaptation de la posologie
n'est requise en cas d'uvéite tant que des traitements locaux efficaces peuvent
contrôler l'inflammation oculaire. Si l'uvéite ne répond pas aux traitements
oculaires locaux, le dabrafenib doit être interrompu jusqu'à la résolution de
l'inflammation oculaire puis le dabrafenib doit être réintroduit à une dose
réduite d'un palier. Aucune modification de la dose de trametinib n'est requise
lorsqu'il est pris en association au dabrafenib (voir la rubrique Mises en garde spéciales et précautions d'emploi).
Tumeurs malignes
non cutanées RAS mutées
Les bénéfices et les risques
doivent être évalués avant de continuer le traitement par dabrafenib chez les
patients présentant une tumeur maligne non cutanée associée à une mutation RAS.
Aucune modification de dose de trametinib n'est requise lorsqu'il est pris en
association au dabrafenib (voir la rubrique Mises en garde spéciales et précautions d'emploi).
Populations particulières
Insuffisants
hépatiques
Aucune adaptation posologique n'est nécessaire chez
les patients ayant une insuffisance hépatique légère. Les données disponibles
issues d'une étude clinique de pharmacologie indiquent un impact limité de
l'insuffisance hépatique modérée à sévère sur l'exposition au trametinib (voir
la rubrique Propriétés pharmacocinétiques).Le trametinib doit être utilisé avec prudence en cas
d'insuffisance hépatique modérée à sévère.
Insuffisants
rénaux
Aucune adaptation posologique
n'est nécessaire chez les patients ayant une insuffisance rénale légère à
modérée. Aucune donnée clinique n'est disponible avec le trametinib chez les
patients ayant une insuffisance rénale sévère et par conséquent l'éventuelle
nécessité d'adapter la posologie ne peut être déterminée (voir la rubrique
Propriétés pharmacocinétiques). Le trametinib doit être utilisé avec prudence chez les patients
présentant une insuffisance rénale sévère.
Population
pédiatrique
La sécurité et l'efficacité de l'association
trametinib et dabrafenib chez les enfants âgés de moins de 1 an n'ont pas été
établies. Aucune donnée n'est disponible. Des études réalisées chez de jeunes
animaux ont mis en évidence des effets du trametinib qui n'ont pas été observés
chez les animaux adultes (voir la rubrique Données de sécurité préclinique). Les données de sécurité à
long-terme chez les patients pédiatriques sont actuellement limitées.
Mode d'administration
Spexotras est à prendre par voie orale.
La poudre de Spexotras doit être reconstituée en solution buvable par le pharmacien avant d'être délivrée. Il est recommandé qu'un professionnel de santé explique au patient ou à l'aidant comment administrer la dose quotidienne prescrite de solution buvable avant la première administration.
L'exposition au Spexotras n'est pas impactée par la nourriture (voir rubrique Propriétés pharmacocinétiques). Spexotras doit être pris en même temps que dabrafenib comprimé dispersible, qui a une exposition réduite avec la nourriture. Spexotras doit donc être administré sans nourriture, au moins une heure avant, ou deux heures après un repas (voir la rubrique Propriétés pharmacocinétiques). Du lait maternel et/ou infantile peut être donné à la demande si le patient ne peut pas rester à jeun.
Il est recommandé de prendre la dose de Spexotras approximativement à la même heure chaque jour, en utilisant une seringue pour administration par voie orale réutilisable. La dose quotidienne de Spexotras doit être prise tous les jours au même moment que la dose du matin ou du soir de dabrafenib.
Si le patient est incapable d'avaler et qu'il a une sonde nasogastrique in situ, la solution buvable de Spexotras peut être administrée via la sonde d'alimentation.
Les instructions pour la préparation sont fournies en rubrique Précautions particulières d'élimination et de manipulation.
Durée de conservation :
Poudre pour solution buvable
3 ans.
Solution buvable reconstituée
A conserver à une température ne
dépassant pas 25°C.
Ne pas congeler.
Jeter la solution non utilisée
après 35 jours suivant la reconstitution.
Précautions particulières de conservation :
A conserver au réfrigérateur (entre 2°C et 8°C).
A conserver dans l'emballage
d'origine à l'abri de la lumière et de l'humidité.
Pour les conditions de
conservation du médicament après reconstitution, voir la rubrique Durée de conservation.
Sans objet.
Aucun symptôme de surdosage aigu n'a été rapporté chez des patients pédiatriques ayant reçu du trametinib en association au dabrafenib dans les études cliniques. Un surdosage persistant de trametinib pourrait entraîner une augmentation des éruptions cutanées, une diminution de la FEVG ou des anomalies rétiniennes. Il n'y a pas d'antidote spécifique en cas de surdosage. En cas de surdosage, le patient doit recevoir un traitement symptomatique approprié et une surveillance adéquate si nécessaire.
Classe pharmacothérapeutique : Agent antinéoplasique, inhibiteurs de protéine kinase, inhibiteurs de MEK, Code ATC : L01EE01
Mécanisme d'action
Le trametinib est un inhibiteur allostérique, réversible et hautement sélectif de l'activation du signal régulé par MEK 1 (mitogen-activated extracellular signal regulated kinase 1) et MEK2 et de l'activité des kinases. Les protéines MEK sont des composants de la voie régulée par la kinase ERK (extracellular signal related kinase). Dans les cancers chez l'Homme, cette voie est souvent activée par des formes mutées de BRAF qui activent MEK. Le trametinib inhibe l'activation de MEK par BRAF et inhibe l'activité de la kinase MEK.
Association au dabrafenib
Le dabrafenib est un inhibiteur
des RAF kinases. Les mutations oncogéniques BRAF conduisent à une activation
constitutive de la voie de signalisation RAS/RAF/MEK/ERK.
Ainsi, trametinib et dabrafenib inhibent deux kinases de cette voie, MEK et RAF, conduisant ainsi à l'inhibition concomitante par l'association de la voie de signalisation. L'association du trametinib au dabrafenib a montré une activité anti-tumorale in vitro sur les lignées cellulaires de cancer BRAF V600 mutées et retarde l'apparition de résistance invivo des xénogreffes BRAF V600 mutées.
Efficacité et sécurité cliniques
Population pédiatrique
L'efficacité clinique et la
sécurité du traitement par dabrafenib en association au trametinib chez les
patients pédiatriques âgés de 1 à < 18 ans atteints d'un gliome porteur de
la mutation BRAF V600 ont été évaluées dans le cadre de l'étude clinique de
phase II (EudraCT 2015-004015-20), en ouvert, multicentrique. Les patients atteints
de gliome de bas grade (grades 1 et 2 de l'OMS 2016) qui nécessitaient un
premier traitement par voie systémique ont été randomisés selon un rapport 2:1
pour recevoir du dabrafenib avec du trametinib ou du carboplatine avec de la
vincristine, et les patients atteints de gliome de haut grade en rechute ou
réfractaire (grades 3 et 4 de l'OMS 2016) ont été inclus dans un bras unique
avec dabrafenib plus trametinib.
Le statut de mutation BRAF a été identifié de manière prospective dans le tissu tumoral via un test local ou par un test en laboratoire centralisé utilisant le kit bioMérieux, THxID-BRAF lorsqu'un test local n'était pas possible. De plus, une analyse des échantillons de tumeurs disponibles a été effectuée de manière rétrospective en laboratoire centralisé pour confirmer la mutation BRAF V600E.
La posologie du dabrafenib et du trametinib dans l'étude clinique dépendait de l'âge et du poids, le dabrafenib étant administré par voie orale à 2,625 mg/kg deux fois par jour pour les enfants de moins de 12 ans et à 2,25 mg/kg deux fois par jour pour les enfants de 12 ans et plus ; le trametinib a été administré par voie orale à 0,032 mg/kg une fois par jour pour les enfants de moins de 6 ans et à 0,025 mg/kg une fois par jour pour les enfants de 6 ans et plus. Les doses de dabrafenib ont été limitées à 150 mg deux fois par jour et les doses de trametinib à 2 mg une fois par jour. La posologie du carboplatine et de la vincristine dépendait de l'âge et de la surface corporelle avec des doses de 175 mg/m² et 1,5 mg/m², respectivement, en perfusions hebdomadaires. Le carboplatine et la vincristine ont été administrés en cure d'induction de 10 semaines suivi de huit cures d'entretien de 6 semaines.
Le critère principal d'évaluation de l'efficacité dans les deux cohortes était le taux de réponse global (TRG, somme des réponses complètes/RC et partielles/RP confirmées) par une évaluation indépendante basée sur les critères RANO (2017) pour la cohorte GBG, et RANO (2010) pour la cohorte GHG. L'analyse principale a été réalisée lorsque tous les patients des deux cohortes avaient terminé au moins 32 semaines de traitement. L'analyse finale a été réalisée 2 ans après la fin des inclusions dans les deux cohortes.
Gliome de bas grade (Grades 1
et 2 de l'OMS) pédiatrique porteur d'une mutation BRAF
Dans la cohorte des
gliomes de bas grade de l'étude, 110 patients ont été randomisés pour recevoir
dabrafenib plus trametinib (n=73) ou carboplatine plus vincristine (n=37).
L'âge médian était de 9,5 ans, avec 34 patients (30,9 %) âgés de 12 mois à <
6 ans, 36 patients (32,7 %) âgés de 6 à < 12 ans et 40 patients (36,4 %)
âgés de 12 à < 18 ans ; 60 % étaient de sexe féminin. La majorité des
patients (80 %) avait un gliome de grade 1 au diagnostic initial. Les pathologies
les plus fréquentes étaient l'astrocytome pilocystique (30,9 %), le gangliome
(27,3 %) et le GBG sans autre indication (18,2 %). Des sites métastatiques
étaient présents chez 9 patients (8,2 %). Une chirurgie antérieure avait été
rapportée chez 91 patients (82,7 %), dont une résection comme dernière
procédure chirurgicale chez 28 patients (25,5 %). L'utilisation de
corticostéroïdes par voie systémique a été rapporté chez 44 patients (41,5 %).
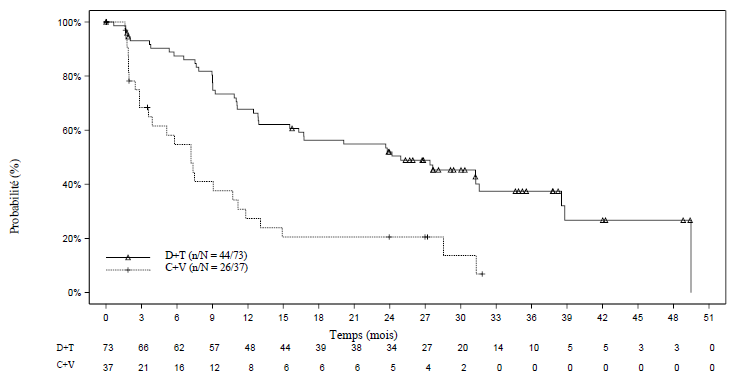
Lors de l'analyse principale, le TRG dans le bras dabrafenib plus trametinib a montré une amélioration statistiquement significative par rapport au bras carboplatine plus vincristine. Les tests hiérarchiques ultérieurs ont également démontré une amélioration statistiquement significative en termes de survie sans progression (SSP) (tableau 6).
Lors de l'analyse principale, conduite après que tous les patients aient terminé 32 semaines de traitement ou aient arrêté le traitement prématurément, les données de survie globale (SG) étaient encore immatures (un décès a été rapporté dans le bras carboplatine plus vincristine (C+V)).
Tableau 6 Réponse et survie sans progression basée sur la revue indépendante dans l'étude pivot G2201 (cohorte GBG, analyse principale)
|
|
Dabrafenib + Trametinib (D+T) N=73 |
Carboplatine + Vincristine (C+V) N=37 |
|
Meilleure réponse globale |
|
|
|
Réponse complète (RC), n (%) |
2 (2,7) |
1 (2,7) |
|
Réponse partielle (RP), n (%) |
32 (43,8) |
3 (8,1) |
|
Maladie stable (MS), n (%) |
30 (41,1) |
15 (40,5) |
|
Progression de la maladie (PD), n (%) |
8 (11,0) |
12 (32,4) |
|
Indéterminé, n (%) |
1 (1,4) |
6 (16,2)1 |
|
Taux de réponse globale |
|
|
|
TRG (RC+RP), (IC à 95%) |
46,6 % (34,8 - 58,6%) |
10,8 % (3,0 - 25,4%) |
|
Odds ratio2, valeur de p |
7,19 (2,3 - 22,4), p<0,001 |
|
|
Différence de risque |
35,8 % (20,6 - 51,0) |
|
|
Survie sans progression (SSP) |
|
|
|
Médiane (mois), (IC à 95 %) |
20,1 (12,8 - NE) |
7,4 (3,6 - 11,8) |
|
Hazard ratio (IC à 95%), valeur de p |
0,31 (0,17 - 0,55), p<0,001 |
|
|
NE = non estimable 1 4 patients randomisés dans le bras C+V sont sortis de l'essai avant de recevoir le traitement. 2 Odds ratio (D+T vs C+V) et un IC à 95 % venant d'une régression logistique avec le traitement comme seule covariable, c'est-à-dire que c'est la chance d'observer une réponse dans le bras D+T comparé à la chance d'observer une réponse dans le bras C+V. L'odds ratio > 1 est en faveur de D+T. |
||
Lors de l'analyse finale (durée médiane de suivi : 39,0 mois), le TRG basé sur la revue indépendante était de 54,8 % dans le bras D+T et de 16,2 % dans le bras C+V avec un odds ratio de 6,26. L'analyse a également confirmé une amélioration de la SSP par rapport à la chimiothérapie, basée sur la revue indépendante, avec une réduction du risque de progression/décès estimée à 64 % (hazard ratio à 0,36).
La SSP était de 24,9 mois dans le bras D+T et de 7,2 mois dans le bras C+V. Au moment de l'analyse finale, aucun décès supplémentaire n'a été rapporté dans les deux bras.
Figure 1 Courbes de Kaplan-Meier de la survie sans progression basée sur la revue indépendante pour l'étude pivot G2201 (cohorte GBG, analyse finale)
Gliome de haut
grade (Grades 3 et 4 de l'OMS) pédiatrique porteur d'une mutation BRAF
Dans la cohorte simple bras de l'étude pour les gliomes de haut grade, 41 patients atteints de gliome de
haut grade en rechute ou réfractaire ont été inclus et traités par dabrafenib plus trametinib. L'âge
médian était de 13,0 ans, avec 5 patients (12,2 %) âgés de 12 mois à < 6 ans, 10 patients (24,4 %) âgés
de 6 à < 12 ans et 26 patients (63,4 %) âgés de 12 à < 18 ans ; 56 % étaient de sexe féminin. Le grade
histologique au diagnostic initial était un grade 4 pour 20 patients (48,8 %), un grade 3 pour
13 patients (31,7 %), un grade 2 pour 4 patients (9,8 %), un grade 1 pour 3 patients (7,3 %) et le grade
était manquant pour 1 patient (2,4 %). Les pathologies les plus fréquentes étaient le glioblastome
multiforme (31,7 %), le xanthoastrocytome anaplasique pléomorphe (14,6 %), le GHG sans autre
indication (9,8 %) et le xanthoastrocytome pléomorphe (9,8 %). Une chirurgie antérieure avait été
rapportée chez 40 patients (97,6 %), dont une résection comme dernière procédure chirurgicale chez
24 patients (58,5 %). Une chimiothérapie antinéoplasique antérieure a été rapportée chez 33 patients
(80,5 %). Une radiothérapie antérieure a été rapportée chez 37 patients (90,2 %). L'utilisation de
corticostéroïdes par voie systémique pendant le traitement a été rapportée chez 24 patients (58,5 %).
Lors de l'analyse finale (durée médiane de suivi : 45,2 mois), le TRG basé sur la revue indépendante était de 56,1 % (23/41), (IC à 95 % : 39,7 - 71,5) : RC chez 14 patients (34,1 %) et RP chez 9 patients (22,0 %). La durée de réponse médiane (DDR) était de 27,4 mois (IC à 95 % : 9,2 - NE).
Les propriétés pharmacocinétiques du trametinib ont principalement été déterminées chez des patients adultes à partir de la formulation solide (comprimé). La pharmacocinétique du trametinib après administration unique ou répétée ajustée en fonction du poids a également été évaluée chez 244 patients pédiatriques. Les caractéristiques pharmacocinétiques (taux d'absorption du médicament et clairance du médicament) du trametinib chez les patients pédiatriques étaient comparables à celles des adultes. Il a été constaté que le poids influençait la clairance orale du trametinib, contrairement à l'âge. Les expositions pharmacocinétiques au trametinib à la posologie recommandée ajustée en fonction du poids chez les patients pédiatriques se situaient dans les limites de celles observées chez les adultes.
Absorption
La solution buvable de trametinib a été absorbée rapidement avec un temps médian pour atteindre la concentration plasmatique maximale (Tmax) de 1 heure après administration. La biodisponibilité orale absolue moyenne des comprimés de trametinib était de 72 %. Dans une étude de biodisponibilité relative comparant la formulation solution buvable et la formulation comprimé après une administration unique chez l'adulte à jeun, l'ASC(0-inf), l'ASC(0-terminale), et la Cmax étaient augmentées de 12 %, 10 % et 71 % respectivement après l'administration de la solution buvable par rapport à la formulation comprimé.
L'exposition au trametinib a augmenté proportionnellement à la dose entre 0,125 mg et 4 mg à la suite d'une administration répétée quotidienne.
Dans l'étude pivot pédiatrique, la moyenne géométrique à l'état d'équilibre (CV %) de la Cmax et l'ASCtau étaient de 22,7 ng/mL (41,1 %) and 339 ng*hr/mL (22,2 %) dans la cohorte GBG et 21,3 ng/mL (36,3 %) and 307 ng*hr/mL (22,8 %) dans la cohorte GHG.
Lors d'administrations répétées quotidiennes, le trametinib s'accumule. Un rapport moyen d'accumulation de 6,0 a été observé pour la formulation comprimés à 2 mg une fois par jour. L'état d'équilibre a été atteint au jour 15.
Effets de la nourriture
L'administration d'une dose unique de 2 mg de trametinib solution orale avec un repas pauvre en
graisse, pauvre en calories, a entraîné une diminution de la Cmax de 12 % par rapport à un état à jeun,
qui n'est pas considéré cliniquement significative. L'ASCterminale est restée inchangée.
Distribution
Le trametinib se lie à 97,4 % aux protéines plasmatiques humaines. Le volume de distribution du trametinib à l'état d'équilibre après administration d'une microdose intraveineuse de 5 µg est d'environ 1200 L.
Biotransformation
Les études in vitro et in vivo ont montré que le trametinib était principalement métabolisé par désacétylation seule ou en association avec une mono-oxygénation. Le métabolite désacétylé était ensuite métabolisé par glucuronidation. L'oxydation par CYP3A4 est considérée comme une voie mineure de métabolisation. La désacétylation est réalisée par les carboxylestérases 1b, 1c et 2, avec la participation potentielle d'autres enzymes hydrolytiques.
Suite à l'administration d'une dose unique et de doses répétées, le trametinib en tant que composé parent est le principal composé circulant dans le plasma.
Élimination
La demi-vie terminale du trametinib après administration d'une dose unique est de 127 heures (5,3 jours). La clairance apparente du trametinib chez les patients pédiatriques (poids médian : 32,85 kg) était 3,44 L/h (CV de 20 %).
Après l'administration par voie orale d'une dose unique de trametinib radiomarqué en solution, la quantité totale de la dose retrouvée était faible (< 50 %) d'après les prélèvements effectués sur une période de 10 jours, du fait d'une longue demi-vie d'élimination. Les substances liées au trametinib étaient majoritairement excrétées dans les fèces (> 80 % de la radioactivité retrouvée) et dans une moindre mesure dans l'urine (≤ 19 %). Moins de 0,1 % de la dose excrétée a été retrouvée en tant que composé parent dans les urines.
Interactions médicamenteuses
Effets du trametinib sur les enzymes métabolisant et
transportant les médicaments
Les données in vitro et in vivo
suggèrent qu'il est peu probable que le trametinib affecte la pharmacocinétique
d'autres médicaments. Sur la base d'études in vitro, le trametinib n'est
pas un inhibiteur de CYP1A2, CYP2A6, CYP2B6, CYP2D6 et CYP3A4. Sur la base
d'études in vitro, le trametinib est un inhibiteur de CYP2C8, CYP2C9 et
CYP2C19, un inducteur de CYP3A4 et un inhibiteur des transporteurs OAT1, OAT3,
OCT2, MATE1, OATP1B1, OATP1B3, P-gp et BCRP. Cependant, sur la base de la
faible dose et de la faible exposition systémique clinique par rapport à la
puissance des valeurs inhibitrices et inductrices in vitro, trametinib
n'est pas considérécomme un inhibiteur ou inducteur in vivo de
ces enzymes ou transporteurs, bien qu'une inhibition transitoire des substrats
des BCRP puisse survenir au niveau intestinal (voir la rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
Effets d'autres médicaments sur le trametinib
Les données in vivo et in vitro
suggèrent qu'il est peu probable que la pharmacocinétique du trametinib soit
affectée par d'autres médicaments. Le trametinib n'est pas un substrat des
enzymes CYP, ni des transporteurs BCRP, OATP1B1, OATP1B3, OATP2B1, OCT1, MRP2,
et MATE1. Trametinib est un substrat de BSEP et du transporteur d'efflux P-gp
in vitro. Bien qu'il soit peu probable que l'exposition au trametinib soit
affectée par l'inhibition de BSEP, une augmentation des taux de trametinib
secondaire à une puissante inhibition du P-gp hépatique ne peut être exclue
(voir la rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
Effets du trametinib sur d'autres médicaments
L'effet d'une dose répétée de
trametinib sur l'état d'équilibre pharmacocinétique de contraceptifs oraux
combinés, norethistérone et ethinylestradiol, a été évalué dans une étude
clinique comprenant 19 patientes avec des tumeurs solides. L'exposition à la norethistérone
a été augmentée de 20% et celle à l'ethinylestradiol est restée similaire
lorsqu'ils étaient administrés concomitamment au trametinib. Sur la base de ces
résultats, aucune perte d'efficacité des contraceptifs hormonaux n'est attendue
lorsqu'ils sont administrés concomitamment au trametinib.
Populations particulières
Insuffisance hépatique
Les analyses pharmacocinétiques
de la population et les données issues d'une étude clinique de pharmacologie
chez des patients adultes ayant une fonction hépatique normale ou une élévation
légère, modérée ou sévère des taux de bilirubine et/ou d'ASAT (selon la
classification du National Cancer Institute [NCI]) indiquent que la fonction
hépatique n'a pas d'effet significatif sur la clairance orale du trametinib.
Insuffisance rénale
Il est peu probable que l'insuffisance rénale ait un effet
cliniquement pertinent sur la pharmacocinétique du trametinib du fait de la
faible élimination rénale du trametinib. La pharmacocinétique du trametinib a
été caractérisée par une analyse pharmacocinétique de population, chez 223
patients adultes qui présentaient une insuffisance rénale légère et 35 patients
adultes qui présentaient une insuffisance rénale modérée inclus dans les études
cliniques avec le trametinib.
L'insuffisance rénale légère à modérée
n'a pas d'effet sur l'exposition au trametinib (< 6 %). Aucune donnée n'est
disponible chez des sujets présentant une insuffisance rénale sévère(voir
la rubrique Posologie et mode d'administration).
Origine ethnique
Les données sont insuffisantes
pour évaluer l'effet potentiel de la race sur les paramètres pharmacocinétiques
du trametinib dans la mesure où l'expérience clinique est limitée aux patients
caucasiens.
Genre
Sur la base de l'analyse
pharmacocinétique de la population de patients adultes et pédiatriques, il a
été constaté que le sexe influençait la clairance orale du trametinib. Bien
qu'il soit prévu que les patientes soient plus exposées que les patients
masculins, ces différences sont peu susceptibles d'être cliniquement
pertinentes et aucun ajustement posologique n'est justifié.
Le trametinib a une influence mineure sur l'aptitude à conduire des véhicules et à utiliser des machines. L'état clinique du patient et le profil des effets indésirables du trametinib doivent être pris en compte lors de l'évaluation de la capacité du patient à effectuer des tâches qui font appel au discernement ou à des aptitudes motrices ou cognitives. Les patients devront être informés du risque potentiel de fatigue, de sensations vertigineuses ou de problèmes oculaires qui peuvent affecter ces activités.
Aucune étude de carcinogénicité n'a été réalisée avec le trametinib. Le trametinib n'était pas mutagène dans les tests évaluant les mutations sur des bactéries, les aberrations chromosomiques dans les cellules de mammifères en culture et dans un test conduit sur des micronoyaux dans la moelle osseuse chez des rats.
Le trametinib peut affecter la fertilité chez les femmes. Dans les études à doses répétées, une augmentation des follicules et une diminution des corps jaunes ovariens a été observée chez les rats femelles à des expositions inférieures à l'exposition clinique humaine, d'après l'ASC.
De plus, il a été observé chez de jeunes rats sous trametinib, une diminution du poids ovarien, un léger retard des caractéristiques de maturité sexuelle chez la femelle (ouverture vaginale et augmentation de l'incidence de bourgeons terminaux proéminents dans la glande mammaire) et une légère hypertrophie de la surface de l'épithélium de l'utérus. Tous ces effets étaient réversibles suite à une période d'arrêt du traitement et attribuables à la pharmacologie. Cependant, dans les études de toxicité chez le rat et le chien conduites sur 13 semaines au maximum, aucun effet du traitement n'a été observé sur les tissus reproductifs des mâles.
Dans les études de développement embryo-foetal chez les rats et les lapins, le trametinib a entraîné une toxicité maternelle et sur le développement embryonnaire. Chez les rats, une diminution du poids du fœtus et une augmentation des pertes post-implantatoires ont été observées à des expositions inférieures ou légèrement supérieures aux expositions cliniques chez l'Homme, d'après l'ASC. Dans une étude de toxicité sur le développement embryo-foetal chez des lapines, une diminution du poids fœtal, une augmentation des avortements, une augmentation de l'incidence d'ossification incomplète et de malformations du squelette ont été observées à des expositions inférieures aux expositions cliniques, d'après l'ASC.
Dans les études à doses répétées, les effets après exposition au trametinib sont principalement retrouvés au niveau de la peau, du tractus gastro-intestinal, du système hématologique, des os et du foie. La plupart des cas sont réversibles après disparition du médicament. Chez les rats, une nécrose hépatocellulaire et des élévations des transaminases ont été vues après 8 semaines à des expositions ≥ 0,062 mg/kg/jour (environ 0,8 fois l'exposition clinique humaine, d'après l'ASC).
Chez la souris, un ralentissement cardiaque, une diminution du poids du cœur et de la fonction du ventricule gauche ont été observés sans histopathologie cardiaque après 3 semaines à des doses ≥ 0,25 mg/kg/jour de trametinib (environ 3 fois l'exposition clinique humaine, d'après l'ASC). Chez les rats adultes, une minéralisation de différents organes a été associée à une augmentation de la phosphorémie et a été étroitement liée à une nécrose du cœur, du foie et des reins, une hémorragie pulmonaire à des expositions comparables à l'exposition clinique humaine. Chez le rat, une hypertrophie osseuse et une augmentation du renouvellement osseux ont été observées. Chez le rat et le chien recevant du trametinib à des doses égales ou inférieures aux doses cliniques chez l'Homme, une nécrose de la moelle osseuse, une atrophie lymphoïde du thymus et dans le tissu lymphoïde associé au tube digestif (GALT) et une nécrose lymphoïde des ganglions lymphatiques, la rate et le thymus ont été observées, pouvant affecter la fonction immunitaire. Chez les jeunes rats, une augmentation du poids du cœur sans histopathologie a été observée à une dose de 0,35 mg/kg/jour (environ 2 fois l'exposition clinique chez l'Homme sur la base de l'ASC).
Trametinib s'est révélé phototoxique lors d'un test in vitro 3T3 NRU (Neutral Red Uptake) réalisé sur fibroblastes de souris à des concentrations significativement supérieures aux expositions cliniques (CI50 de 2,92 μg/mL, ≥ 130 fois l'exposition clinique chez l'Homme estimée sur la base de la Cmax), suggérant que le risque de phototoxicité chez les patients prenant trametinib est faible.
Association au dabrafenib
Au cours d'une étude chez le chien, dans laquelle trametinib et dabrafenib ont été administrés en association pendant 4 semaines, des signes de toxicités gastro-intestinales et une diminution de la cellularité lymphoïde du thymus ont été observés à une exposition plus faible que chez les chiens recevant trametinib seul. Les autres toxicités étaient similaires à celles observées dans les études comparables en monothérapie.
Spexotras en poudre doit être reconstituée en solution buvable par un pharmacien avant d'être délivré.
Instructions pour la reconstitution (pour le pharmacien uniquement):
- Lavez et séchez vos mains.
- Vérifiez la date d'expiration sur le flacon.
- Tapotez le flacon pour décoller la poudre.
- Retirez le bouchon et ajoutez 90 mL d'eau distillée ou purifiée à la poudre dans le flacon.
- Revissez le bouchon et retournez le flacon de façon répétée pendant 5 minutes maximum, jusqu'à ce que la poudre soit complètement dissoute. Vous pouvez également secouer doucement le flacon.
- Séparez l'adaptateur pour flacon de la seringue pour voie orale. Retirez le bouchon et insérez l'adaptateur dans le goulot du flacon. Poussez fort jusqu'à ce que l'adaptateur soit complétement rentré. L'adaptateur doit complètement affleurer le goulot du flacon.
- Ecrivez la date de la préparation sur la boîte. La solution expire 35 jours après la préparation.
- Informez le destinataire de la dose et de la date à laquelle la solution a été préparée.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Liste I.
Médicament nécessitant une surveillance particulière pendant
le traitement.
Prescription hospitalière.
Prescription réservée aux médecins compétents en
CANCEROLOGIE.
Prescription réservée aux spécialistes et services ONCOLOGIE
MEDICALE.
Poudre pour solution buvable.
Poudre blanche ou blanchâtre.
Flacon en verre ambré de 180 mL avec un bouchon à vis muni d'une sécurité enfant, contenant 12 g de poudre.
Chaque boîte contient un flacon, un adaptateur pour flacon et une seringue réutilisable pour voie orale de 20 mL avec des graduations tous les 0,5 mL.
Un flacon contient du diméthylsulfoxyde de trametinib correspondant à 4,7 mg de trametinib.
Chaque mL de la solution reconstituée contient 0,05 mg de trametinib.
Excipients à effet notoire
Chaque mL de solution reconstituée contient 100 mg de sulfobutyle bétadex de sodium, 0,8 mg de méthyle de parahydroxybenzoate et 1,98 mg de sodium.
Pour la liste complète des excipients, voir rubrique Liste des excipients.
Sulfobutyle bétadex de sodium
Sucralose (E 955)
Acide citrique monohydraté (E
330)
Phosphate disodique (E 339)
Sorbate de potassium (E 202)
Parahydroxybenzoate de méthyle (E
218)
Arôme fraise
Pour se procurer Finlee et Spexotras, contacter Alloga du
lundi au vendredi de 9h à 17h30 :
o Par téléphone : N°0800 002 787
o Par courriel à l'adresse : officines.novartis@alloga.fr
Produit à reconstituer par le pharmacien avec une eau purifié ou distillée (non
fournie par Novartis).
Instruction pour la reconstitution de SPEXOTRAS par le pharmacien :
1. Avant de faire la reconstitution, se laver les mains et
sécher.
2. Bien vérifier la date d’expiration sur le flacon.
3. Tapoter le flacon pour décoller la poudre.
4. Retirer ensuite le bouchon et ajouter 90ml d’eau distillée
ou purifiée à la poudre dans le flacon.
5. Revisser le bouchon et retourner le flacon de façon
répétée pendant 5 minutes maximum, jusqu’à ce que la poudre soit complètement
dissoute. Il est également possible de secouer doucement le flacon.
6. Séparer l’adaptateur pour le flacon de la seringue pour
voie orale. Retirer le bouchon et insérer l’adaptateur dans le goulot du
flacon. Pousser fort jusqu’à ce que l’adaptateur soit complètement rentré.
L’adaptateur doit complètement affleurer le goulot du flacon.
7. Ecrire la date de la préparation sur le flacon. La
solution expire 35 jours après la reconstitution.
8. Informer le destinataire de la dose et de la date à
laquelle la solution a été préparée.
